服务团支招|新的口罩和药品,都以最快速度在路上——医疗器械应急审批机制和药品特别审批程序
时间: 2020-02-20 访问量:808
广西律师协会新冠肺炎疫情防控工作专项法律服务团普法推文
自新型冠状病毒肺炎疫情发生以来,口罩的生产和供应、药物研发作为疫情防控的关键环节,一直备受各方关注。在口罩方面,一“罩”难求,2020年2月7日实施重点医疗物资政府兜底采购收储之前,不少地方的药房门口,老百姓都排起了长龙购买口罩;在药品方面,无论是被人们连夜排队抢购、后来被群嘲的双黄连,还是被网民谐称为“人民的希望”的“瑞得西韦”,都带给老百姓们所谓的“希望”。在这场艰难的战“疫”中,口罩等医疗器械和药品,无异于是这场没有硝烟的疫情阻击战中最重要的盔甲和武器。
“同时间赛跑,与疫情抗争”,各项工作刻不容缓。在口罩等疫情防控急需医疗器械的生产和药品研发方面,法律上规定了相应的应急程序,且医疗器械和药品的应急程序均已启动。新的口罩和药品,都以最快速度在路上。
一、口罩等医疗器械应急审批
主要规定:《突发事件应对法》《突发公共卫生事件应急条例》《医疗器械生产监督管理条例》《医疗器械注册管理办法》《医疗器械分类目录》《国家食品药品监督管理局关于印发医疗器械应急审批程序的通知》
在国家食品药品监督管理局(以下简称“国家药监局”)指导下,近期,多个省级药品监管部门迅速启动医疗器械应急审批程序,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,对疫情防控所急需的医疗器械开展应急审批。
就医疗器械的生产应急审批,何时会启动?哪些医疗器械可适用应急审批?应急审批比日常审批快了多少?就上述相关问题,我们根据相关规定阐述如下。
(一)医疗器械应急审批程序何时启动?
《国家食品药品监督管理局关于印发医疗器械应急审批程序的通知》第二条规定:“存在突发公共卫生事件威胁时,以及突发公共卫生事件发生后,食品药品监督管理部门按照统一指挥、早期介入、快速高效、科学审批的原则,对突发公共卫生事件应急处理所需医疗器械实施应急审批。”第三条第1款规定:“国家食品药品监督管理局根据突发公共卫生事件的情形和发展情况,决定启动及终止本程序的时间。”因此,存在突发公共卫生事件威胁时、突发公共卫生事件发生后,由国家药监局决定启动医疗器械实施应急审批,并由其决定终止该程序时间。
就本次疫情,国家药监局在2020年1月26日发布《国家药监局党组传达贯彻中央政治局常委会会议精神 进一步部署落实新型冠状病毒感染的肺炎疫情防控工作》,要求“全力支持疫情防控所需疫苗药品、医疗器械的科研攻关,主动与相关科研院所和企事业单位对接,对疫情防控所需药械全部实行应急审批,确保能够以最快的速度投入使用”。之后,多个省级药品监管部门迅速启动医疗器械应急审批程序。以广西壮族自治区为例,2020年2月6日,广西壮族自治区药品监督管理局印发《新型冠状病毒感染肺炎疫情防控所需医疗器械应急审批程序》,全力支持疫情防控所需医疗器械的科研攻关和供应保障。这表明国家药监局已对本次疫情所需医疗器械的生产正式启动了应急审批程序。
(二)哪些医疗器械可以适用应急审批程序?
《国家食品药品监督管理局关于印发医疗器械应急审批程序的通知》第四条规定:“本程序适用于突发公共卫生事件应急所需,且在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要,并经国家食品药品监督管理局确认的医疗器械的审批。”由此,可以适用应急审批程序的医疗器械有两类:1.适用于突发公共卫生事件应急所需,且在中国境内尚无同类产品上市;2.适用于突发公共卫生事件应急所需,虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要。
具体到本次疫情中,国家药监局器械注册司稽查专员江德元在2020年2月8日举办国务院联防联控机制新闻发布会上表示,截至7日16时,相关省级药品监管部门已经按照医疗器械应急审批的程序批准医疗器械注册申请88个,包括一次性防护服15个,医用防护口罩4个,医用外科口罩17个,一次性使用医用口罩20个。
(三)应急审批比日常审批快了多少?
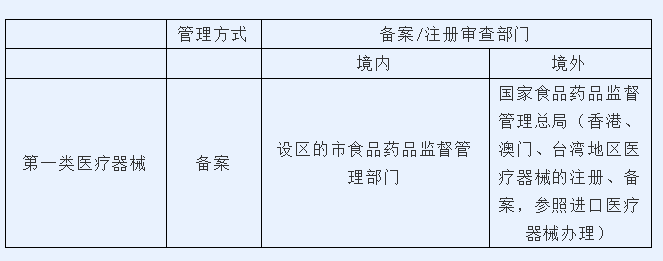
我国对医疗器械按照风险程度实行分类管理,对第一类医疗器械实行备案管理,第二类、第三类医疗器械实行注册管理。《医疗器械监督管理条例》第四条规定:“国家对医疗器械按照风险程度实行分类管理。第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。”《医疗器械注册管理办法》第五条规定:“第一类医疗器械实行备案管理。第二类、第三类医疗器械实行注册管理。境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。境内第二类医疗器械由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料。进口第二类、第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。”分类管理制度也贯彻于医疗器械日常审批程序和应急审批程序中。
1.医疗器械日常审批程序
根据《医疗器械注册管理办法》《医疗器械生产监督管理条例》,一般情况下,就三类医疗器械,具体管理方式如下:
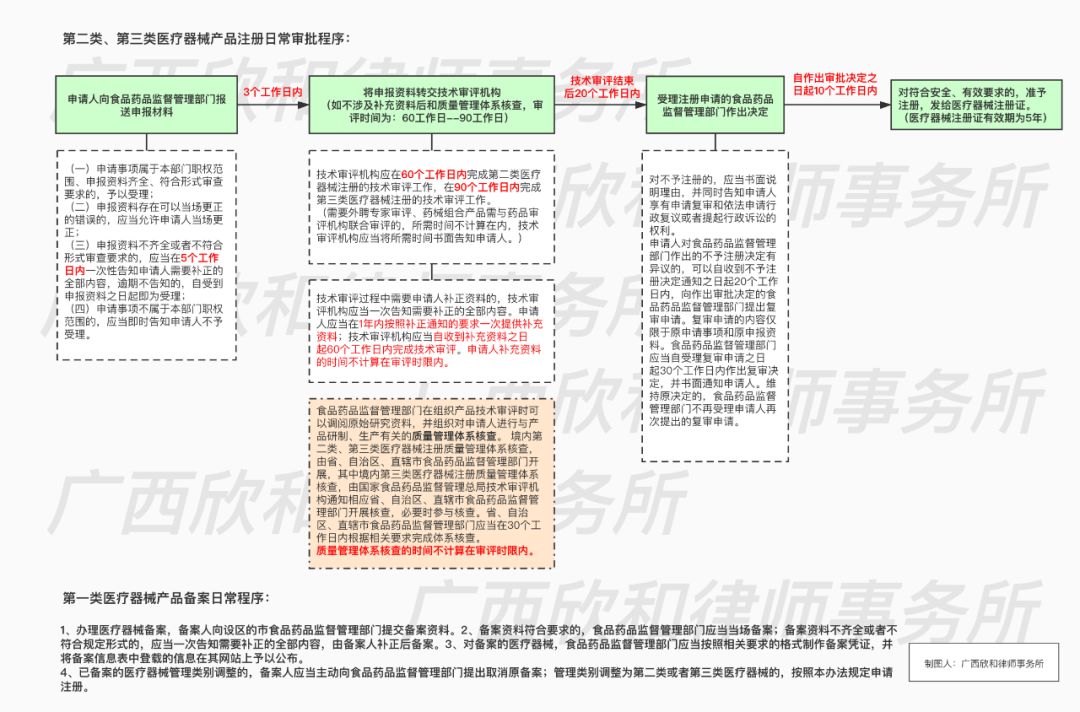
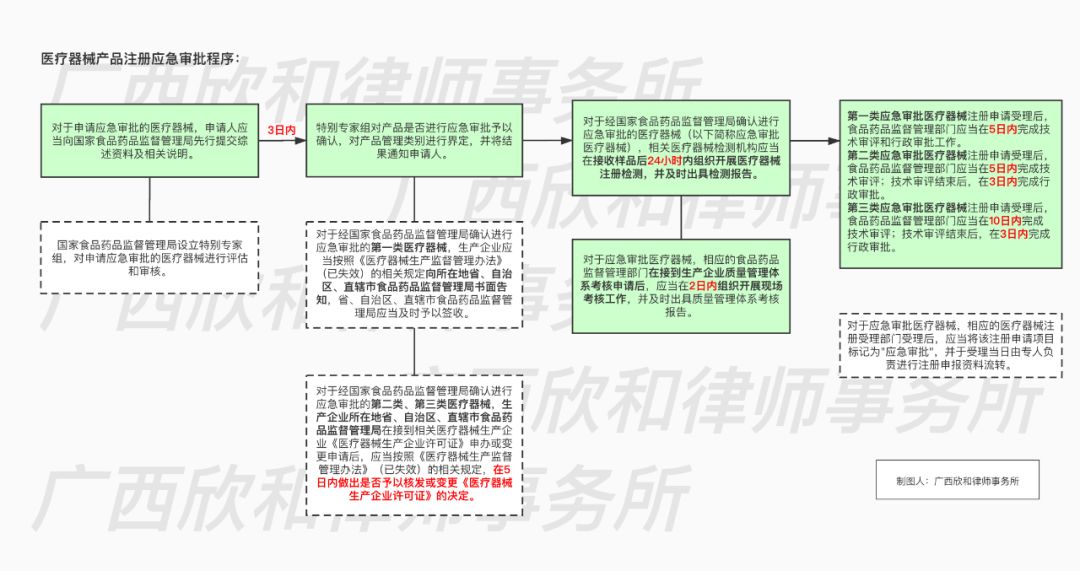
对于经国家食品药品监督管理局确认进行应急审批的第一类医疗器械,生产企业应当按照《医疗器械生产监督管理办法》的相关规定向所在地省、自治区、直辖市食品药品监督管理局书面告知;对于第二类、第三类医疗器械,生产企业所在地省、自治区、直辖市食品药品监督管理局在接到相关医疗器械生产企业《医疗器械生产企业许可证》申办或变更申请后,做出是否予以核发或变更《医疗器械生产企业许可证》的决定。根据《国家食品药品监督管理局关于印发医疗器械应急审批程序的通知》,审批流程如下:
二、药品附条件审批和特别审批
主要规定:《药品管理法》《传染病防治法》《突发事件应对法》《药品管理法实施条例》《突发公共卫生事件应急条例》《国家食品药品监督管理局药品特别审批程序》《药品注册管理办法》
2020年1月21日,国家药监局药品审评中心即启动了应急审评机制。
2020年2月14日,据国家药监局《肖亚庆在国家药监局药品审评中心调研时要求 科学优化审评审批流程 助力临床急需药品研发》报道,要严格按照“安全守底线、疗效有证据、质量能保证”要求,打破常规、特事特办,对符合疫情防控和诊疗所需的临床药物,开通绿色通道,提前介入指导,加快审评审批,确保尽早投入使用。
药品和疫苗的研发也上演着“生死时速”。2020年2月15日下午,国务院联防联控机制新闻发布会上表示,在多轮筛选的基础上,科研攻关组聚焦到少数几个药品如磷酸氯喹、伦地西韦、法匹拉韦等一批药物,先后开展临床试验,目前部分药物已经初步显示出良好的临床疗效;疫苗是防控传染病最有力的手段之一,为确保尽早研发成功,在科研攻关应急项目中并行安排了多条技术路线,包括灭活疫苗、mRNA疫苗、重组蛋白疫苗、病毒载体疫苗、DNA疫苗等并行推进,切实保障成功率。根据中国临床实验注册中心数据,截至2020年2月16日凌晨1时,相关单位共启动了128项有关新型冠状病毒肺炎临床研究。
通常情况下,一种药物从研发到临床试验到上市会经历非常漫长的过程,可能要花费长达数年的时间。但是,我国《药品管理法》中规定的“附条件审批”和《国家食品药品监督管理局药品特别审批程序》规定的“特别审批”,均对防治疫情用药规定了绿色通道。
(一)药品附条件审批
2020年8月26日,十三届全国人大常委会第十二次会议表决通过了新修订的《药品管理法》。该法于2019年12月1日起实施。此次修订对临床急需的短缺药、防治重大传染病和罕见病等疾病的新药、儿童用药开设绿色通道,实行优先审评审批制度。建立附条件审批制度,以提高临床急需药品的可及性,缩短临床试验研制时间,使急需治疗的患者在第一时间用上新药。
《药品管理法》第二十六条规定:“对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项。”第九十六条规定:“国家鼓励短缺药品的研制和生产,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批。”根据上述规定,如果临床试验证明某些药物对于治疗新冠病毒感染肺炎有效,那么国家药监局可以对相关药物实施附条件批准。
(二)药品特别审批程序
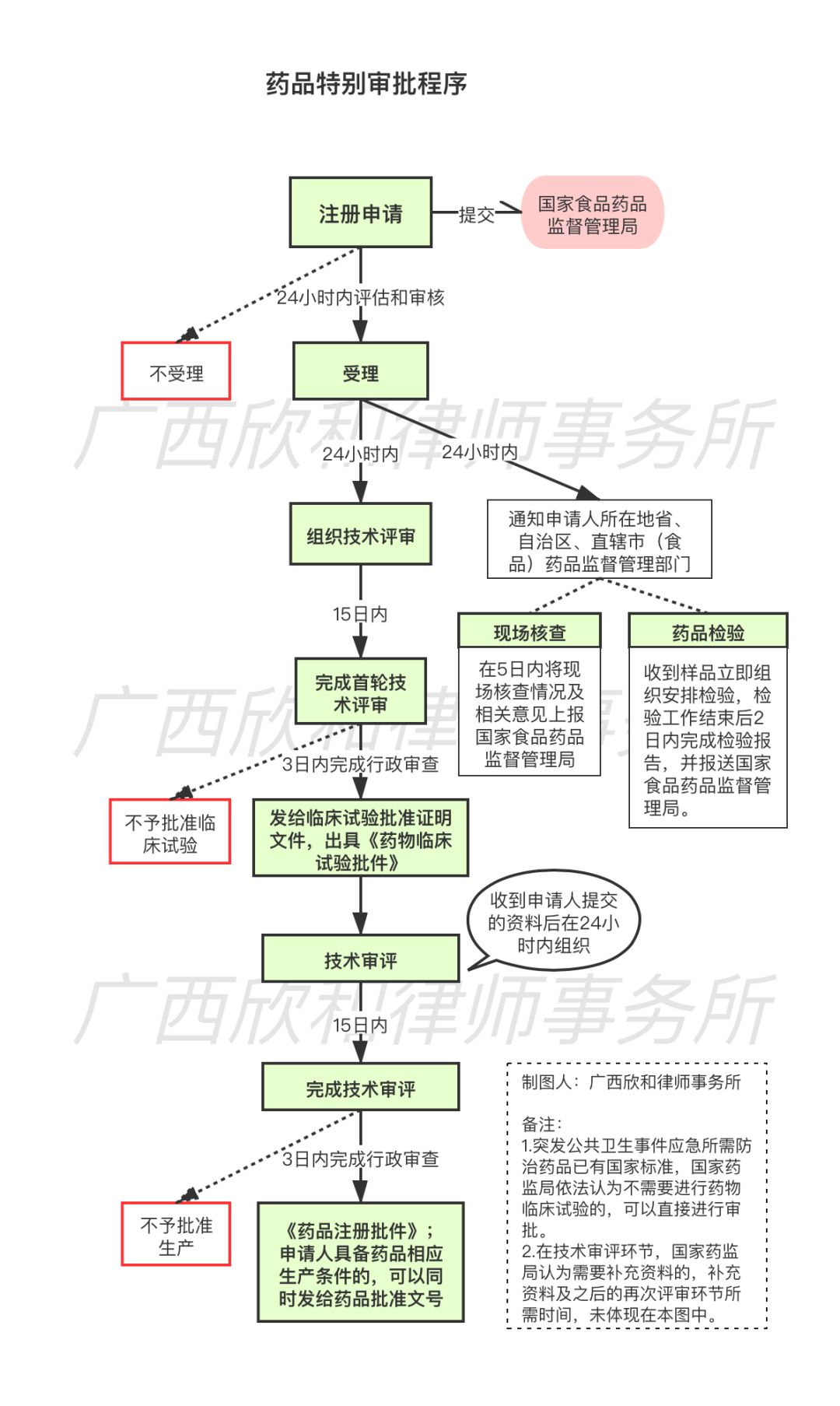
为使突发公共卫生事件应急所需防治药品尽快获得批准,2005年11月18日,《国家食品药品监督管理局药品特别审批程序》由国家药监局公布和施行。
1.药品特别审批程序何时启动?
根据《国家食品药品监督管理局药品特别审批程序》第三条规定,存在以下情形时,国家食品药品监督管理局可以依法决定按照本程序对突发公共卫生事件应急所需防治药品实行特别审批:
(1)中华人民共和国主席宣布进入紧急状态或者国务院决定省、自治区、直辖市的范围内部分地区进入紧急状态时;
(2)突发公共卫生事件应急处理程序依法启动时;
(3)国务院药品储备部门和卫生行政主管部门提出对已有国家标准药品实行特别审批的建议时;
(4)其他需要实行特别审批的情形。
2.药品由哪个部门进行审批?
根据《国家食品药品监督管理局药品特别审批程序》第四条和第五条之规定, 药品特别审批程序启动后,突发公共卫生事件应急所需防治药品的注册申请、临床试验、生产和进口等事项,均由国家药监局负责受理和审批。
省、自治区、直辖市(食品)药品监督管理部门受国家药监局委托,负责突发公共卫生事件应急所需防治药品的现场核查及试制样品的抽样工作。
3.特别审批程序需要多长时间?
通常情况下,药品注册是一个复杂而漫长的过程,以药品检验为例,根据《药品注册管理办法》第一百四十九条,仅药品注册检验,样品检验时间为30日,特殊药品和疫苗类制品的样品检验时间60日。但根据特别审批程序,药品检验机构收到样品后立即检验。在药品特别审批程序中,药品注册各个环节,均尽量了缩短审批时间。我们绘制了下图,以帮助直观了解药品特别审批程序。
2.http://www.nmpa.gov.cn/WS04/CL2055/374828.html 《肖亚庆在国家药监局药品审评中心调研时要求 科学优化审评审批流程 助力临床急需药品研发》
来源:广西律协新冠肺炎疫情防控工作专项法律服务团
供稿:广西欣和律师事务所
作者:赵荣蓉律师、黄舒舒(实习)律师
长按识别二维码即可关注广西战疫大数据
↓↓↓